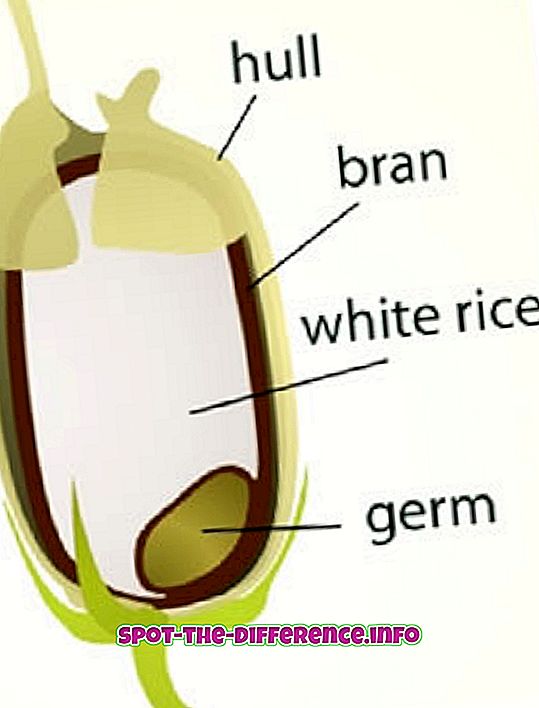
Nøgleforskel: Cell er en elektrokemisk celle, der danner elektrisk energi fra spontan redox reaktion inde i cellen. Et batteri er dybest set intet andet end en stabel eller bunke af elektrokemiske eller galvaniske celler.
Batterier er en vigtig opfindelse for samfundet; de bruges i næsten alle applikationer, herunder lygter, mobiltelefoner, ure, vækkeure osv. Forestil dig en verden, hvor batterier ikke eksisterede, og alt ville kun køre på elektricitet, mængden af ledninger, der ville være omkring, ville være irriterende og farligt. Batterier udvikles konstant med synspunkterne om at forsøge at finde stoffer, der ville opretholde gebyrer i længere tid. Batterier spiller også en vigtig rolle i mobilitet, med elbiler bliver populære. Batterier og celler er mere ens, da cellerne er det, der strømmer batteriet, mens batteriet styrer enheden.

En elektrokemisk celle består af to halvceller. Hver halvcelle består af en elektrode og en elektrolyt. De to halvceller kunne anvende samme elektrolyt. Under reaktionen mister arten fra en halvcelle elektroner (oxidation) til deres elektrode, mens arten anden halvcelle opnår elektroner (reduktion). Saltbroen eller den porøse skive anvendes til at tillade ionisk kontakt mellem de to halvdele uden at blande opløsningerne. Når elektronerne overføres fra den ene side til den anden, fastlægges forskellen i afgifter. Saltbroen gør det muligt for ionerne at opretholde en balance mellem oxidationen og reduktionen. De to elektroder er kendt som anoden og katoden, og begge er forbundet med et højt modstandsdygtigt voltmeter. Voltmeteret hjælper elektroderne til at opretholde en spænding. Forskellen mellem afgifterne konverteres derefter til elektrisk energi til brug i bærbare gadgets.
Et batteri er dybest set intet andet end en stabel eller bunke af elektrokemiske eller galvaniske celler. Den italienske fysiker Alessandro Volta krediteres med at opfatte det første batteri i 1800 ved at samle mange celler i en serie. Udtrykket "voltaic celle" eller "voltaic pile" er givet til ære for Volta. Men han var ikke den person til at opfatte ordet "batteri". Bunken af celler er kendt som "batteri" på grund af Benjamin Franklin. Han var den første person til at sætte udtrykket 'batteri' i brug. Franklin beskrev flere Leyden krukker (som blev brugt som kondensatorer) som batteri, der henviser til analogien til et batteri af kanoner. Batteri af kanoner er normalt et udtryk for at beskrive en række kanoner, som er placeret med jævne mellemrum for at gøre det let at skyde.

Der er også forskellige antal batterityper, der omfatter vådcelle, tørcelle, smeltet salt og reserve. Vådcellebatteri har en flydende elektrolyt, mens tørcellen har en elektrolyt, der er immobiliseret som en pasta, som kun er flydende nok til at tillade strømmen af elektroner. Smeltede saltbatterier bruger smeltet salt som elektrolyt. Disse bruges ofte i elektriske køretøjer; men de skal være ordentligt isolerede, da denne type batteri genererer meget varme. Et reservebatteri er et batteri, som ofte opbevares i en uassocieret form og kun aktiveres, når de indvendige dele er samlet. Disse batterier kan opbevares i længere tid og er ofte en del af nødsituationskits. Disse batterier giver kun strøm i nogle få minutter.
Batterier kan også laves til forskellige typer materialer som alkalisk, lithiumion, kviksølv, zink-carbon, nikkel-zink batteri, blybatteri, brændselscelle osv. Den sædvanlige spænding for et alkalisk batteri er 1, 5 V og spændingen kan øges ved at tilføje på flere batterier. De forskellige størrelser af batterier omfatter (4, 5-Volt, D, C, AA, AAA, AAAA, A23, 9-Volt, CR2032, LR44 osv.). I afhængighed af batteriets anvendelse kombineres cellerne for at give en højere spænding, for eksempel et 9-volts batteri ville have 6 alkaliske celler med en 1, 5 V opladning. Et 9 Volt batteri bruges i de kraftige flashlygter. Den mest almindelige type batteri, der bruges på markedet, er et AA-batteri eller et AAA-batteri.